Bezpečnost a snášenlivost RAVICTI®1,2
RAVICTI® (glycerolfenylbutyrát) je souhrnně zdokumentován a ověřen pro léčbu poruch močovinového cyklu.
Nejčastější nežádoucí účinky hlášené v klinických studiích (nejméně 10 % pacientů) byly:
- Dospělí pacienti: průjem, plynatost, bolest hlavy, nevolnost, zvracení, snížená chuť k jídlu, závratě a únava.
- Dětští pacienti ve věku 2 až 17 let: bolest břicha, vyrážka, nevolnost, zvracení, průjem, snížená chuť k jídlu a bolest hlavy.
- Dětští pacienti ve věku od 2 měsíců do méně než 2 let: neutropenie, zvracení, zácpa, průjem, horečka, snížená chuť k jídlu (hypofagie), kašel, ucpaný nos, silný výtok z nosu, vyrážka a papuly.
- Dětští pacienti mladší 2 měsíců: zvracení, vyrážka, gastroezofageální reflux, zvýšená aktivita jaterních enzymů, porucha příjmu potravy (snížená chuť k jídlu, hypofagie), anémie, kašel, dehydratace, metabolická acidóza, trombocytóza, trombocytopenie, neutropenie, lymfocytóza, průjem, plynatost, zácpa, horečka, letargie a podrážděnost/neklid.
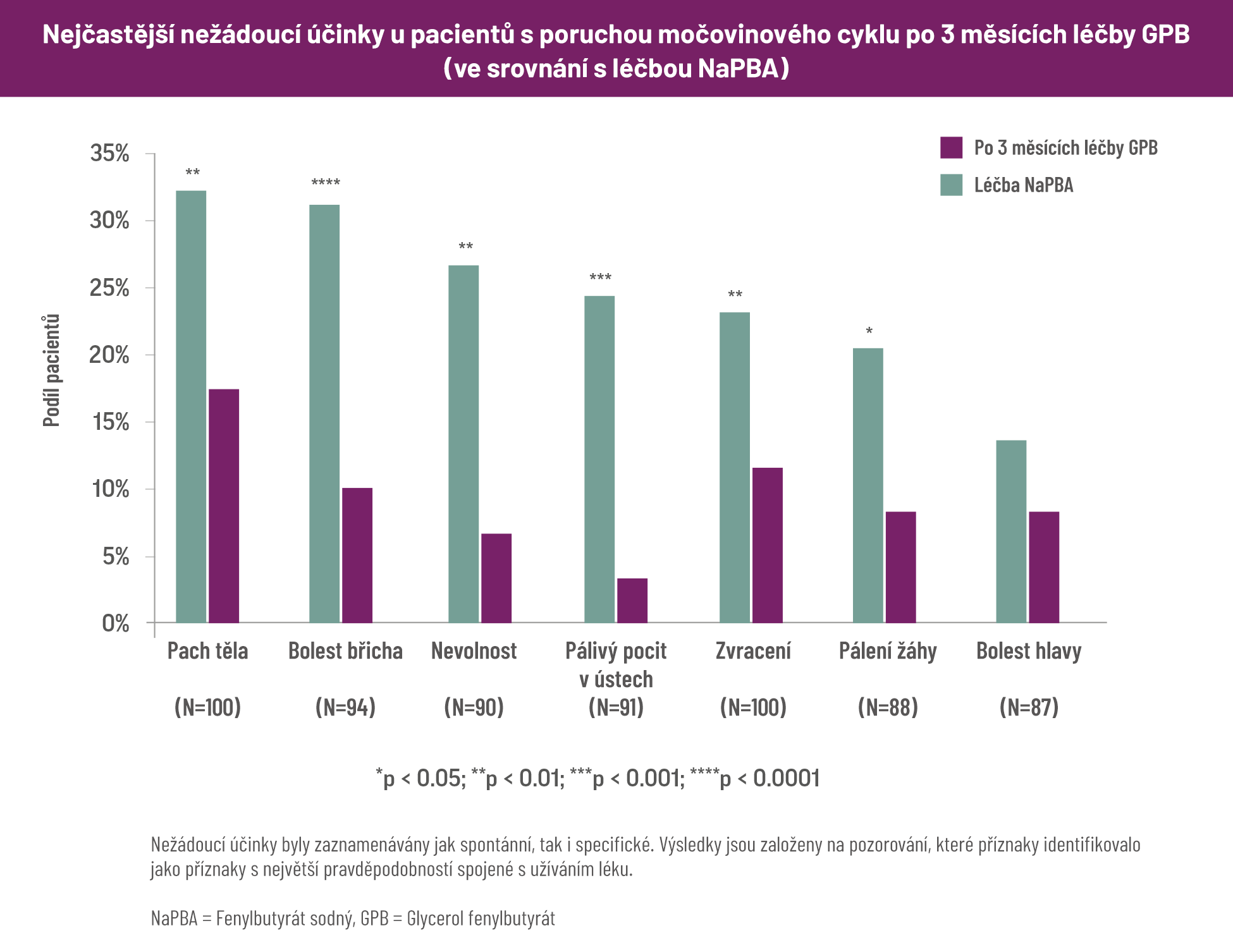
Nežádoucí účinky spojené s léčbou – RAVICTI vs NaPBA
Sto pacientů nebo jejich pečovatelů odpovědělo na nevalidovaný dotazník specifický pro UCD včetně předem definovaného seznamu běžných příznaků spojených se zachytávačmi dusíku. Výchozí hodnoty (když pacienti užívali fenylbutyrát [NaPBA]) byly porovnány s hodnotami po tříměsíční léčbě glycerolfenylbutyrátem (GPB).3
Zvláštní upozornění a opatření pro použití
I při léčbě glycerolfenylbutyrátem se může u části pacientů objevit akutní hyperamonémie včetně hyperamonemické encefalopatie.
- Přecitlivělost na léčivou látku
- Léčba akutní hyperamonémie
Exokrinní pankreatické enzymy hydrolyzují glycerolfenylbutyrát v tenkém střevě a oddělují aktivní složku, fenylbutyrát od glycerolu. Tento proces umožňuje vstřebání fenylbutyrátu do krevního oběhu. Chybějící pankreatické enzymy nebo enzymy ve sníženém množství, případně střevní onemocnění vedoucí k malabsorpci tuků, to vše může mít za následek snížené nebo chybějící trávení glycerolfenylbutyrátu a/nebo absorpci fenylbutyrátu a sníženou kontrolu plazmatického čpavku.
Hladina čpavku by měla být pečlivě sledována u pacientů s nedostatečnou funkcí slinivky břišní nebo se střevní malabsorpcí.
Denní dávka by měla být individuálně upravena podle odhadované syntetické kapacity močoviny pacienta, profilu aminokyselin, tolerance bílkovin a denního příjmu bílkovin ve stravě potřebných k podpoře růstu a vývoje. Pro udržení esenciálních aminokyselin a aminokyselin s rozvětveným řetězcem v normálním rozmezí mohou být nezbytné doplňkové aminokyselinové přípravky. Další úprava může být založena na monitorování plazmatického amoniaku, glutaminu, U-PAGN a/nebo plazmatického PAA a PAGN a také poměru plazmatického PAA:PAGN (viz bod 4.2 v souhrnu údajů o léčivém přípravku).
Kortikosteroidy
Použití kortikosteroidů může způsobit rozklad tělesného proteinu a zvýšit hladinu čpavku v plazmě. Při současném užívání kortikosteroidů a glycerolfenylbutyrátu pečlivě sledujte hladiny amoniaku.
Kyselina valproová a haloperidol
Hyperamonémie může být vyvolána haloperidolem a kyselinou valproovou. Pokud je u pacientů s UCD nezbytné použití kyseliny valproové nebo haloperidolu, pečlivě sledujte hladinu čpavku.
Probenecid
Probenecid může potlačit renální vylučování metabolitů glycerolfenylbutyrátu včetně PAGN.
Ženy ve fertilním věku by měly užívat účinnou antikoncepci (viz bod 4.6 v souhrnu údajů o léčivém přípravku).
RAVICTI by neměl být užíván během těhotenství a u žen ve fertilním věku, které nepoužívají antikoncepci, pokud klinický stav ženy nevyžaduje léčbu glycerolfenylbutyrátem, viz bod 4.6 v souhrnu údajů o léčivém přípravku.
Bezpečnostní zprávy a reklamace produktů
▼ Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé a řádné rozšíření bezpečnostních informací. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Nežádoucí účinky musí být neprodleně reportovány. Formuláře pro podání zprávy lze nalézt na adrese: www.mhra.gov.uk/yellowcard. Nežádoucí příhody by měly být také hlášeny společnosti Immedica e-mailem: safety@immedica.com
Pokud byste chtěli nahlásit stížnost na produkt, měla by být nahlášena v souladu s požadavky platnými v daném státě, a především by měla být nahlášena ve vaší místní lékárně. Můžete také kontaktovat Immedica Quality na adrese: complaints@immedica.com
Reference:
1. Evropská hodnotící zpráva RAVICTI.
2. Souhrn údajů o přípravku RAVICTI.
3. Nagamani SC a kol. Mol Genet Metab. 2015;116:29–34.

